Alcoholes, fenoles, éteres, tioles y sulfuros
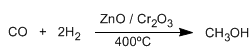
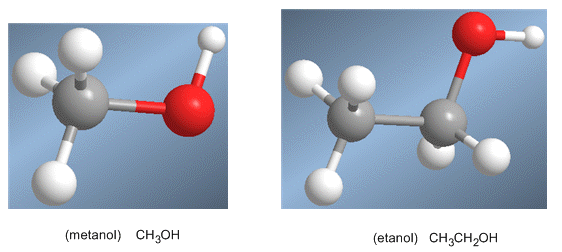
PROPIEDADES FISICAS DE ALCOHOLES
El grupo –OH es polar y capaz de formar enlaces de hidrógeno. • Esto permite que alcoholes de bajo peso molecular sean solubles en agua. • Ejemplo: Enlaces de hidrógeno en una solución agua-metano
Propiedades generales
Los alcoholes son líquidos incoloros de baja masa molecular y de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 ºC).
También disminuye la solubilidad en agua al aumentar el tamaño de la molécula, aunque esto depende de otros factores como la forma de la cadena alquílica. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua. Sus puntos de fusión y ebullición suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un p.f. de -16 ºC y un p.eb. de 197 ºC.
Propiedades químicas de los alcoholes
Las propiedades químicas de los alcoholes están relacionados con el grupo -OH, que es muy polar y capaz de establecer puentes de hidrógeno con sus moléculas compañeras, con otras moléculas neutras, y con aniones.
NOMENCLATURA
IUPAC
Los alcoholes se nombran en el sistema IUPAC como derivados del alcano principal, usando el sufijo -ol:
Se elige la cadena de carbono más larga que contenga al grupo hidroxilo, y se determina el nombre principal reemplazando la terminación -o del alcano correspondiente por -ol (o bien la terminación -ano por -anol).
Se numera la cadena del alcano comenzando por el extremo más próximo al grupo hidroxilo.
Se numeran todos los sustituyentes conforme a su posición en la cadena, y se escribe el nombre con los sustituyentes en orden alfabético.
SISTEMA COMÚN
Los nombres comunes de los alcoholes incluyen la palabra "alcohol", y se nombra el grupo alquilo unido al grupo -OH con la terminación "ico". A continuación se incluyen los nombres IUPAC y, entre paréntesis, los nombres comunes de los ocho alcoholes de peso molecular más bajo.
Hay compuestos más complejos que se pueden nombrar únicamente por el sistema IUPAC, por ejemplo:
En el sistema IUPAC, el compuesto que presenta dos grupos hidroxilo se llama diol, el que contiene tres grupos hidroxilo triol, y así sucesivamente. En los nombres de la IUPAC de los dioles, trioles, etc., se retiene el sufijo -o del nombre del alcano original; por ejemplo 1,2-etanodiol Como ocurre con diversos compuestos orgánicos, aún se continúan usando los nombres comunes de ciertos dioles y trioles. Los compuestos que contienen dos grupos hidroxilo sobre carbonos adyacentes se llaman, a menudo, glicoles. El etilenglicol (1,2-etanodiol) y el propilenglicol (1,2-propanodiol) se sintetizan a partir del etileno y propileno, respectivamente, y ahí se derivan sus nombres comunes.
Nomenclatura de Alcoholes - Reglas IUPAC

Nomenclatura de Alcoholes - Problema 7.1
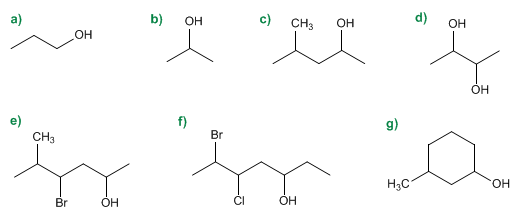
Nomenclatura de Alcoholes - Problema 7.2
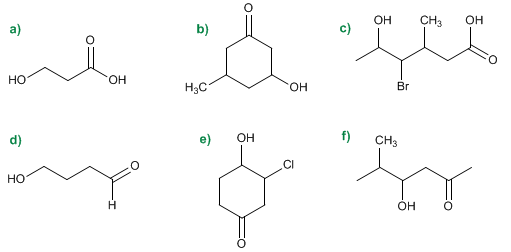
Nomenclatura de Alcoholes - Problema 7.3
| a) Etanol b) Butanol c) 2-Metilpropan-1-ol d) 2-Metilbutan-2-ol e) 3-Metilbutan-2-ol f) 3-Metilbutan-1-ol g) 2,3-Pentanodiol h) 2-Etil-pent-3-en-1-ol | i) Ciclopent-2-enol j) 2,3-Dimetilciclohexanol k) Octa-3,5-dien-2-ol l) Hex-4-en-1-in-3-ol m) 2-Bromohep-2-en-1,4-diol n) 2-Fenil-5-metilheptan-2-ol o) Alcohol bencílico p) 1,2,3-Propanotriol (glicerina) |
Los fenoles son compuestos orgánicos aromáticos que contienen el grupo hidroxilo como su grupo funcional. Están presentes en las aguas naturales, como resultado de la contaminación ambiental y de procesos naturales de descomposición de la materia orgánica. La débil acidez del grupo fenólico ha determinado que se los agrupe químicamente junto a los ácidos carboxílicos y a los taninos, conformando así el grupo de los ácidos orgánicos.
Las concentraciones naturales de compuestos fenólicos son usualmente inferiores a 1 µg/l y los compuestos más frecuentemente identificados son fenol, cresol y los ácidos siríngico, vainíllico y p-hidroxibenzoico. En aguas contaminadas es posible detectar otros tipos, como los clorofenoles, fenilfenol y alquilfenol. En rellenos sanitarios, su concentración total puede ser próxima a los 20 mg/l.
Los grupos funcionales fenólicos son importantes en las sustancias húmicas acuáticas. Estos tipos de fenoles combinados le confieren sabor y olor al agua, aunque su ingestión no resulta peligrosa.
 |
NOMENCLATURA DE FENOLES
ETERES
PROPIEDADES FÍSICAS Y DE ENLACE DE ÉTERES
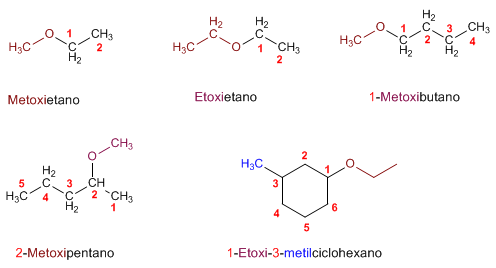
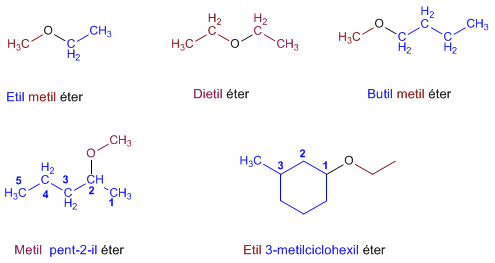
Nomenclatura de Éteres - Reglas IUPAC
- Regla 1. Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el alcóxido como un sustituyente.
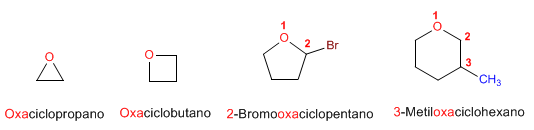
 |

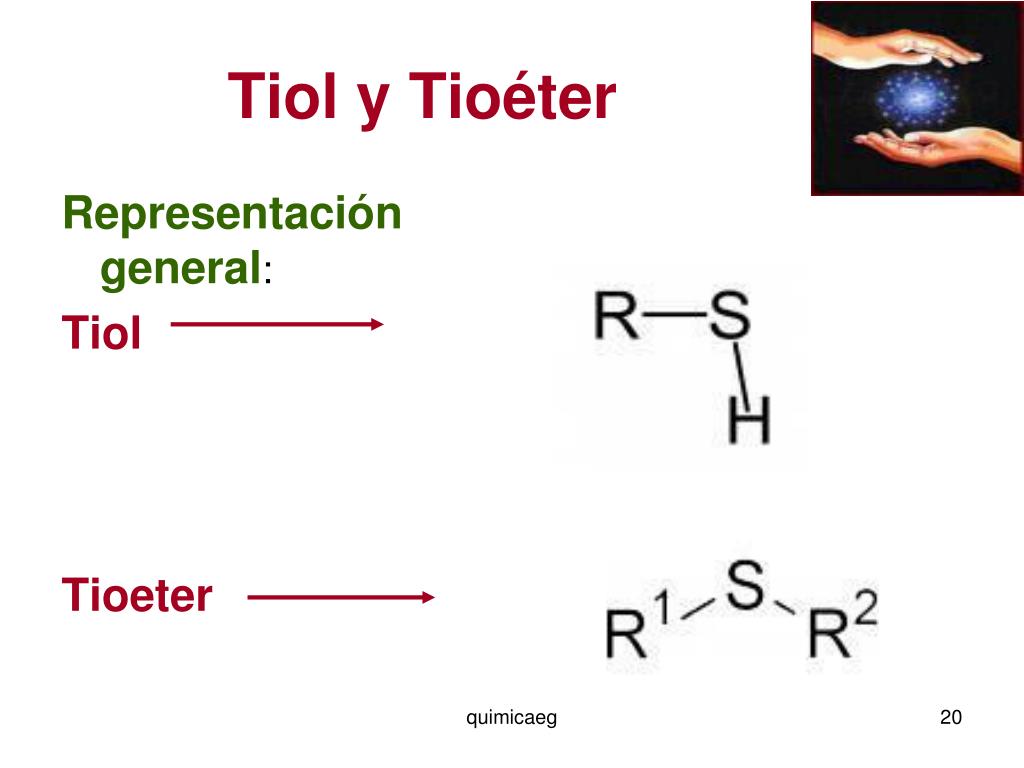
TIOLES
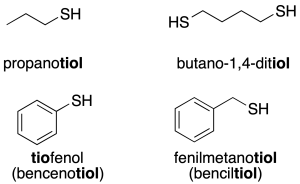
Los tioles son semejantes a alcoholes, pero en lugar de oxígeno contienen azufre. Cuando el grupo -SH es la función principal, la molécula se nombra con la terminación -tiol; cuando actúa como sustituyente, se utiliza el prefijo mercapto-. Dos cadenas hidrocarbonadas pueden estar unidas por un puente de azufre, formando una función tioéter (o sulfuro). A veces, este puente puede estar formado por dos azufres (R-S-S-R'), formando lo que se llama un puente disulfuro. Es el caso de la cistina (dos cisteínas conectadas por un puente disulfuro). Los tioles también pueden reaccionar con los ácidos carboxílicos para formar tioésteres. Los enlaces tioéster son enlaces ricos en energía e intervienen en multitud de procesos del metabolismo, generalmente con la intervención de la acil-coenzima A (acil-CoA). Los tioles, R-SH, son análogos azufrados de los alcoholes. Los tioles se nombran por medio del sistema que se usa para los alcoholes, con el sufijo - tiol en lugar de -ol. El grupo -SH mismo se conoce como grupo mercapto. 36 CH3 CH2 SH etanotiol etilmercaptano CH3 SH metanotiol metilmercaptano • La propiedad más característica de un tiol es su olor, La raza humana es muy sensible a estos compuestos pudiendo detectar su presencia a niveles 0,02 partes de tiol en mil millones de partes de aire. El olor de los zorrillos se debe, principalmente, a algunos tioles sencillos. NomenclaturaCuando un grupo tiol es un sustituyente de un alcano, hay varias formas de nombrar al tiol resultante:
EtimologíaEl término mercaptano viene del latín mercurius captans, que significa 'capturado por mercurio', debido a que el grupo –SH se une estrechamente al elemento mercurio. Propiedades físicasOlorMuchos tioles son líquidos incoloros que tienen un olor parecido al del ajo. El olor de tioles es a menudo fuerte y repulsivo, en particular los de bajo peso molecular. Los tioles se unen fuertemente a las proteínas de la piel y son responsables de la intolerable persistencia de olores producidos por las mofetas. Los distribuidores de gas natural comenzaron añadiendo diversas formas de tioles acres, por lo general etanotiol, al gas natural que es inodoro, después de la mortífera explosión de 1937 en el New London School en New London, Texas. Los tioles son también responsables de una clase de fallos en los vinos causados por la reacción no deseada entre el azufre y la levadura. Sin embargo, no todos los tioles tienen olores desagradables. Por ejemplo, los mercaptanos del pomelo son un tiol monoterpenoide responsables del aroma característico de este. Puntos de ebullición y solubilidadDebido a la pequeña diferencia de electronegatividad entre el azufre y el hidrógeno, un enlace S-H es prácticamente apolar covalente. Por lo tanto, el enlace S-H en los tioles tiene menor momento dipolar en comparación con el enlace O-H del alcohol. Los tioles muestran poca asociación por enlaces de hidrógeno con el agua y las moléculas entre sí. Por lo tanto tienen puntos de ebullición inferiores y son menos solubles en agua y otros disolventes polares que los alcoholes de similar peso molecular pero siendo tan solubles y con similares puntos de ebullición como los sulfuros isoméricos. Propiedades químicasSíntesisLos métodos utilizados para sintetizar tioles son análogos a los utilizados para la síntesis de alcoholes y éteres. Las reacciones son más rápidas y de mayor rendimiento porque los aniones de azufre son mejores nucleófilos que los átomos de oxígeno. Los tioles se forman cuando un haloalcano se calienta con una solución de hidrosulfuro de sodio
Además, los disulfuros pueden reducirse fácilmente por agentes reductores como el hidruro de litio aluminio en éter seco para formar dos tioles.
ReaccionesEl grupo tiol es el análogo del azufre al grupo hidroxilo (-OH) que se encuentran en los alcoholes. Debido a que el azufre y el oxígeno pertenecen al mismo grupo de la tabla periódica, comparten algunas propiedades de enlace similares. Al igual que el alcohol, en general la forma desprotonada RS− (llamado tiolato) es químicamente más reactiva que la forma tiol protonada RSH. La química de tioles está relacionada con la de los alcoholes: los tioles forman tioéteres, tioacetales y tioésteres, que son análogos a los éteres, acetales y ésteres. Por otra parte, un grupo tiol puede reaccionar con un alqueno para formar un tioéter. (De hecho, bioquímicamente, los grupos tiol pueden reaccionar con grupos vinilo para formar un enlace tioéter.) AcidezEl átomo de azufre de un tiol es muy nucleofílico, bastante más que el átomo de oxígeno del alcohol. El grupo tiol es bastante ácido, con el pKa habitualmente alrededor de 10 a 11. En la presencia de una base se forma un anión tiolato, que es un muy potente nucleófilo. El grupo y su correspondiente anión son fácilmente oxidados por reactivos como el bromo para dar disulfuro orgánico (R-S-S-R).
La oxidación por reactivos más poderosos como el hipoclorito de sodio o peróxido de hidrógeno resulta en ácidos sulfónicos (RSO3H).
TIOETERES Son compuestos orgánicos cuyo grupo funcional está formado por un puente de azufre entre dos cadenas carbonadas, ya sea alifáticas o aromáticas. Este tipo de compuesto se asemeja a los éteres, cuyos puentes en este caso son de oxígeno (R-O-R). Además el oxigeno y el azufre son elementos que pertenecen al mismo grupo de la tabla periódica (grupo 16), lo que hace que estos presenten algunas características similares.
Clasificación de los tioéter Tioéteres simétricos. Son aquellos que presentan grupos R iguales. Por ejemplo: CH3-CH2-CH2-S-CH2-CH2-CH3 Tioéteres asimétricos. Son aquellos que presentan grupos R diferentes. Por ejemplo: CH3–S-CH2-CH2-CH3
Propiedades físicas.
Reactividad Los tioéter son compuestos bastante reactivos a comparación de los éteres que suelen ser bastante estables. Los tioéter se oxidan fácilmente a sulfóxidos (R-SO-R’), los que pueden ser oxidados más aún a sulfonas (R-(SO)2-R’).
Origen y Aplicaciones de algunos tioéter Sulfuro de dietilo. Este compuesto es el responsable del efecto picante y el olor de los ajos. Sulfuro de fenilo. También llamado como sulfuro de polifenileno es un plástico que se utiliza actualmente como un termoplástico de alto rendimiento ya que soporta temperaturas hasta de 218 °C. Biotina. Llamada también vitamina B7 es una vitamina hidrosoluble que es esencial para la síntesis y degradación de grasas y la degradación de ciertos aminoácidos. Además es fundamental ya que actúa como cofactor de enzimas que intervienen en la catálisis de reacciones metabólicas esenciales para sintetizar ácidos grasos, en la gluconeogénesis y en el metabolismo de la leucina. Es utilizada para aliviar dolores musculares, el eczema y la dermatitis, y también ayuda a combatir la depresión y la somnolencia. Metionina. Es un aminoácido esencial no apolar que actúa como intermediario en la biosíntesis de la cisteína, la carnitina, la taurina, la lecitina, la fosfatidilcolina y otros fosfolípidos. Al igual que la cisteína, la metionina es uno de los dos aminoácidos proteinogénicos que contienen azufre.
Nomenclatura IUPAC y Común Nomenclatura IUPAC. Primeramente se debe elegir la cadena carbonada principal o hidrocarburo base, el cual será el que contenga mayor cantidad de átomos de carbono. La cadena que posea menos cantidad de carbono, se nombrará como un radical
Puedes apoyarte de mejor manera con estos videos que explican acerca de los Tioles o Tioesteres Nomenclatura de tioles y Nomenclatura de sulfuros o tioéteres GRACIAS POR VISITARNOS ❤ |


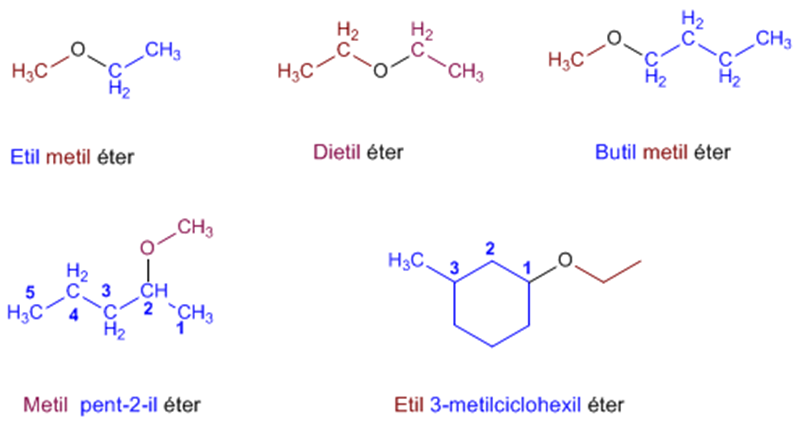

Cuidar el formato, se sea consistente a lo largo de toda su página
ResponderBorrar