Aldehídos, cetonas
El grupo funcional conocido como grupo carbonilo, un átomo de carbono unido a un átomo de oxigeno por un doble enlace- se encuentra en compuestos llamados aldehídos y cetonas.
En los aldehídos.el grupo carbonilo se une a un átomo de hidrógeno y a un radical Alquilo, con excepción del formaldehído o metanal.
En los aldehídos.el grupo carbonilo se une a un átomo de hidrógeno y a un radical Alquilo, con excepción del formaldehído o metanal.





Los aldehídos unidos directamente a un sistema cíclico se nombran añadiendo el sufijo –carbaldehído al nombre del ciclo. Ej: ciclohexanocarbaldehído. Si existen más de dos grupos carbonilo (fuera de la cadena), la cadena principal es la más larga que contenga el mayor número de grupos CHO. El nombre se construye añadiendo los sufijos –tricarbaldehído, etc. al nombre raiz que corresponde a la cadena principal (descontando los carbonos de los grupos carbonilo). Ej: 4-Hidroxi-ciclohexano-carbaldehído C CH2
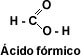
El primer miembro de la serie alifática de los ácidos carboxílicos es el ácido metanóico o ácido fórmico, este ácido se encuentra en la naturaleza segregado por las hormigas al morder.
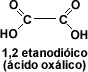
El primer miembro del grupo aromático es el fenilmetanóico o ácido benzóico. Cuando la cadena carbonada presenta dos grupos carboxilo, los ácidos se llaman dicarboxílicos, siendo el primer miembro de la serie alifática el 1, 2 etanodíoco o ácido oxálico.
Nomenclatura
Los ácidos carboxílicos se nombran con la ayuda de la terminación –oico o –ico que se une al nombre del hidrocarburo de referencia y anteponiendo la palabra ácido:
Ejemplo
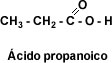
CH3-CH2-CH3 propano CH3-CH2-COOH Ácido propanoico (propan + oico)
En el sistema IUPAC los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido.
El esqueleto de los ácidos alcanoicos se enumera asignando el N° 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH.
En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH ó -CO2H.
Propiedades físicas
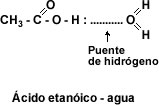
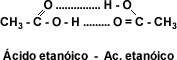
Solubilidad: El grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la molécula de agua. La presencia de dos átomos de oxígeno en el grupo carboxilo hace posible que dos moléculas de ácido se unan entre sí por puente de hidrógeno doble, formando un dímero cíclico.
imagen ácidoetanóico.jpg]”Esto hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos completamente solubles en agua. La solubilidad disminuye a medida que aumenta el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua.
En los ácidos aromáticos monocarboxílicos, la relación carbono-carbono es de 6:1 lo que provoca que la solubilidad se vea disminuida con respecto a los ácidos monocarboxílicos alifáticos.
Los ácidos carboxílicos son solubles en solventes menos polares, tales como éter, alcohol, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más altas que los alcoholes. Estos puntos de ebullición tan elevados se deben a que un par de moléculas del ácido carboxílico se mantienen unidas no por un puente de hidrógeno sino por dos. Los olores de los ácidos alifáticos inferiores progresan desde los fuertes e irritantes del fórmico y del acético hasta los abiertamente desagradables del butírico, valeriánico y caproico; los ácidos superiores tienen muy poco olor debido a sus bajas volatilidades.
Punto de ebullición: Los ácidos carboxílicos presentan puntos de ebullición elevados debido a la presencia de doble puente de hidrógeno.
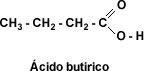
Punto de fusión: El punto de fusión varía según el número de carbonos, siendo más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después de 6 carbonos el punto de fusión se eleva de manera irregular.
Esto se debe a que el aumento del número de átomos de carbono interfiere en la asociación entre las moléculas. Los ácidos monocarboxílicos aromáticos son sólidos cristalinos con puntos de fusión altos respecto a los ácidos alifáticos.
Los ácidos fórmico y acético (1, 2 carbonos) son líquidos de olores irritantes. Los ácidos butíricos, valeriano y capróico (4, 5 y 6 carbonos) presentan olores desagradables. Los ácidos con mayor cantidad de carbonos presentan poco olor.
Las sales de los ácidos carboxílicos son sólidos cristalinos no volátiles constituidos por iones positivos y negativos y sus propiedades son las que corresponden a tales estructuras. Las fuerzas electrostáticas considerables que mantienen los iones en el retículo cristalino sólo pueden superarse por un calentamiento a temperatura elevada o por medio de un solvente muy polar. La temperatura requerida es tan alta que, antes de lograrla, se rompen enlaces carbono−carbono y se descompone la molécula, lo que sucede generalmente entre los 300−400°C. Raras veces es útil un punto de descomposición para la identificación de una substancia, puesto que, generalmente, refleja la rapidez del calentamiento que la identidad del compuesto.
Una base fuerte puede desprotonar completamente en un ácido carboxílico. Los productos son el ión carboxilato, el catión que queda de la base, y agua. La combinación de un ión carboxilato y un catión constituyen la sal de un ácido carboxílico.
Utilidad en la industria de los ácidos carboxílicos
Los ácidos carboxílicos de mayor aplicación industrial son el ácido acético que se utiliza fundamentalmente para la obtención de acetato de vinilo que se utiliza como monómero para la fabricación de polímeros.
También se utiliza en la producción de acetato de celulosa para la obtención de lacas y películas fotográficas, así como en la fabricación de disolventes de resinas y lacas.
La sal alumínica del ácido acético se emplea como mordiente en tintorería. El ácido fórmico se suele emplear en la industria del curtido al objeto de suavizar las pieles y también en los procesos de tintorería en la industria del curtido. Algunos derivados clorados de los ácidos carboxílicos se emplean en la producción de herbicidas.
El ácido benzoico tiene una amplia utilidad como intermediario de síntesis en muchos procesos orgánicos y algunos de sus ésteres se emplean como plastificantes y en la industria de la perfumería (benzoato de bencilo). El benzoato de sodio se emplea en la industria de la alimentación como conservante (zumos, refrescos, mermeladas, etc.).
Entre los ácidos dicarboxílicos, el ácido propanodioico (ácido malónico) se emplea en la elaboración de medicamentos, plaguicidas y colorantes. El ácido 1-4-butanodioico (ácido succínico) se emplea en la obtención de resinas de poliéster para barnices y el ácido trans-butenodioico (ácido fumárico) se emplea como acidulante en la fabricación de refrescos.
¿Qué son los esteres?
Los esteres dentro de la química comprenden a una compleja familia de compuestos de tipo orgánico, los cuales se ven principalmente usados dentro de diferentes fármacos, en el área de los productos para el hogar, de forma natural en las frutas y por intervenciones dentro de las areas de la química. Estos se encuentran mayormente de forma natural, sobretodo en diferentes plantas, y cuando se combina junto a otros compuestos de particularidad volátil acaba produciendo diversos aromas frutales, es por ello que incluye dentro de la industria de los productos para el hogar. Dentro de la química es raro que un solo elemento juegue un papel fundamental, sin embargo, los esteres son de los raros.

Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.

Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster.

A continuacion se te presentara un video que te explica de mejor manera para realizar Acidos Carboxilicos y Esteres











revisado
ResponderBorrar