Alquenos👀
Como una breve introduccion acerca de los alquenos
Se conoce como alquenos a un tipo de hidrocarburos aromáticos en
cuyas moléculas es
posible encontrar enlaces carbono-carbono, es decir, enlaces dobles en su
estructura.
Los alquenos u olefínicos son obviamente sustancias orgánicas que,
junto a los alcanos o
parafínicos, los alquinos o acetilénicos y los cicloalcanos, constituyen
los hidrocarburos aromáticos,
es decir, aquellos que tienen como elemento central el anillo del benceno
(C6H6). Se distinguen en esto último de los alifáticos, cuya piedra fundacional
es el metano (CH4).
A su vez, los hidrocarburos aromáticos pueden clasificarse
en monocíclicos (un solo anillo de benceno) y policíclicos (con
varios anillos entrelazados), así que puede haber alquenos pertenecientes a
ambas clasificaciones.
Sistémicamente estos compuestos se nombran usando la misma regla
que para los alcanos, es decir, usando la partícula latina que aluda a la
cantidad total de carbonos,
pero con el sufijo –eno.
Sin embargo, muchos alquenos se conocen por su nombre no
sistemático (como suele ocurrir con los hidrocarburos) y en ese caso se
sustituye la terminación oficial (–eno) por –ileno, como ocurre con el eteno,
llamado también etileno, o con el propeno, llamado propileno.
Por otro lado, de existir más de un enlace doble, se emplean
respectivamente las terminaciones –dieno o –trieno, etc.
Alquenos - Estructura y Enlace
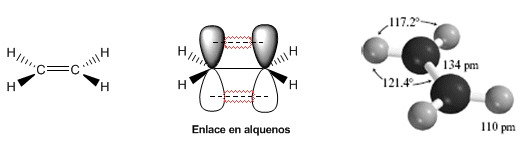
Propiedades físicas de los alquenos
Los alquenos presentan las siguientes propiedades físicas:
- Dependiendo de su cantidad de átomos de carbono, podrán ser gases (menos átomos) o líquidos (más átomos).
- Son insolubles en agua pero solubles en éter, cloroformo o benceno.
- Son menos densos que el agua.
- Presentan polaridad molecular debido al enlace doble.
- Tienen una mayor acidez frente a los alcanos, fruto de la polaridad del enlace.
- Su punto de ebullición y de fusión no varía respecto a los alcanos.
Propiedades químicas de los alquenos
Los alquenos se caracterizan por una elevada reactividad química y sus reacciones mayoritarias son de adición, contrarias a las de sustracción, predominantes en los alcanos, bastante menos reactivos.
Son frecuentes las reacciones de adición de haluros de hidrógeno, de ácido sulfúrico, la oxidación, la hidroxilación y la polimerización, esta última vital en la industria del petróleo y sus derivados, ya que se logran largas y resistentes cadenas de materia maleable (plásticos).
Propiedades físicas
Al igual que los hidrocarburos lineales, sus propiedades están determinadas por el peso molecular de la molécula y la cantidad de dobles enlaces que está presente.
Los cicloalquenos se encuentran con mayor frecuencia como líquidos a temperatura y presión estándar, excepto los dos primeros (C3 y C4) que son gases. Esto se debe a que se necesita una cierta cantidad de carbonos para hacer estructuras de anillo, lo que significa que las moléculas generalmente son demasiado pesadas para ser gaseosas en condiciones estándar. Dependiendo de qué grupos funcionales y cadenas laterales pueda poseer una molécula, algunos cicloalquenos pueden polimerizar en STP formando así una sustancia sólida.
Comparados con los cicloalcanos con igual peso molecular, estos poseen puntos de ebullición mayor. Lo cual se debe a la densidad electrónica que generan los dobles enlaces, por el contrario esto hace que su punto de fusión sea más bajo.
Poseen poca solubilidad en agua, sin embargo son solubles en compuestos orgánicos.
Propiedades químicas
Los cicloalquenos se benefician de una estabilidad mejorada si los dobles enlaces están conjugados. Como mencionamos, el ciclohexeno es uno de esos casos, donde si contiene un total de tres enlaces dobles, ya no se llama ciclohexeno, el anillo con seis átomos de carbono y tres dobles enlaces conjugados se denomina benceno, y este es tan estable que posee una química totalmente diferente.
De forma semejante que los alquenos lineales, los cicloalquenos presentan reacciones de adición sobre el enlace doble por tener mayor energía y menor longitud que un enlace simple. Siendo las principales reacciones de los cicloalquenos las de adición, pero también exhiben reacciones de oxidación, reducción y halogenación.
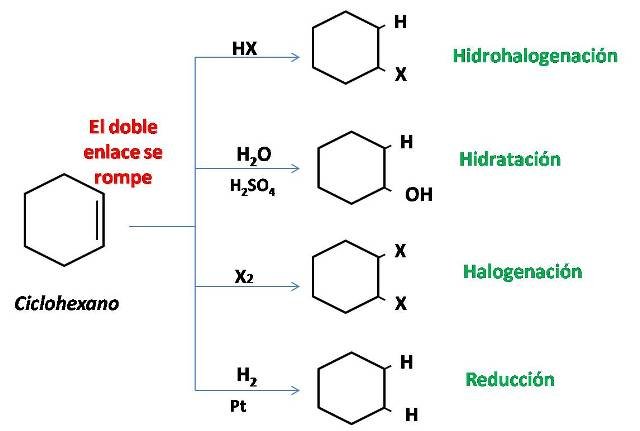
Algunas reacciones
En la siguiente imagen se muestran algunas de las principales reacciones de los cicloalquenos:
A continuacion se te presentera un video que te podra explicar de mejor manera al momento de plantear un ejercicio acerca de los alquenos y cicloalquenos:Nomenclatura de alquenos | Química orgánica | Khan Academy en Español y Nomenclatura de CICLOALQUENOS.

ALQUINOS👾
Los alquinos son hidrocarburos insaturados que contienen en su estructura cuando menos un triple enlace carbono-carbono. Fórmula general: CnH2n-2 La terminación sistémica de los alquinos es INO. El más sencillo de los alquinos tiene dos carbonos y su nombre común es acetileno, su nombre sistémico etino.
La formación de los enlaces triples entre los átomos de carbono ocurre por hibridación sp y formando un enlace Ơ por superposición frontal de dos orbitales sp y dos enlaces ∏ por superposición lateral de dos orbitales p puros de cada átomo. Esto ocurre cuando esos átomos aún no fueron hibridados.
Nomenclatura
El grupo funcional característico de los alquinos es el triple enlace carbono-carbono. La IUPAC nombra los alquinos cambiando la terminación -ano de los alcanos por -ino. Esta terminación está precedida de un localizador que indica la posición del triple enlace dentro de la cadena.
Numeración de la cadena principal
Se numera la cadena principal de manera que el triple enlace tome el localizador más bajo posible. Cuando hay un doble y un triple enlace se numera empezando por el extremo más próximo a cualquiera de los grupos funcionales. Si están a la misma distancia de los extremos se numera empezando por el doble enlace. Los grupos funcionales (-OH), tienen preferencia sobre los triples enlaces y se les asigna el localizador más bajo.
 |
| Agregar leyenda |
Características de los Alquinos.
- Los tres primeros términos de la serie de alquinos que tienen enlaces triples son gaseosos: etino, propino, butino.
- A partir del cuarto término hasta el que tiene 14 átomos de carbono son líquidos.
- Cuando hay más de 14 átomos los alquinos son sólidos.
- Son incoloros.
- No poseen olor (son inodoros).
- Los alquinos son preparados en los laboratorios pues no se encuentran en la naturaleza.
A continuación se te presentara un video que te podra explicar de mejor manera al momento de plantear un ejercicio acerca de los alquinos y cicloalquinos:Nomenclatura de ALQUINOS y Nomenclatura de Cicloalquinos - Lección Teórica.


Indice de Deficiencia de Hidrogeno
La fórmula de grado de insaturación (también conocida como el índice de deficiencia de hidrógeno (IDH) o fórmula de anillos más enlaces dobles, es utilizada para ayudar a dibujar estructuras químicas. La fórmula permite al usuario determinar cuántos anillos, enlaces dobles y enlaces triples están presentes en el compuesto a ser dibujado. No da el número exacto de anillos o enlaces dobles o triples, sino que da la suma de anillos y dobles enlaces, más el doble del número de enlaces triples. La verificación de la estructura final se realiza con el uso de resonancia magnética nuclear, espectrometría de masas y espectroscopia infrarroja, así como por inspección. La fórmula para el grado de insaturación es
donde ni es el número de átomos con valencia vi.
Esto es, un átomo que tiene una valencia de x contribuye con un total de x-2 al grado de insaturación. El resultado es dividido entre dos, y luego incrementado en 2.
Para moléculas que contienen sólo carbono, hidrógeno, halógenos monovalentes, nitrógeno y oxígeno, la fórmula
donde C = número de átomos de carbono, H = número de átomos de hidrógeno, X = número de átomos de halógenos, y N = número de átomos de nitrógeno,2 da un resultado equivalente. El oxígeno y otros átomos divalentes no contribuyen al grado de insaturación, puesto que (2-2) = 0.
El grado de insaturación se utiliza para calcular el número de anillos y enlaces pi, donde
- Cada ciclo cuenta como un grado de insaturación.
- Cada enlace doble cuenta como un grado de insaturación.
- Cada enlace triple cuenta como dos grados de insaturación.
- Cada benceno cuenta como cuatro grados de insaturación.
También puede calcularse por la siguiente fórmula:
G.I.=(2C-H+N-X+2)/2 , donde X es el número de haluros.
Estereoisomería
Como en los alcanos , también se presenta el fenómeno de isomería
Estructural de cadena como:
CH2 ═ CH─CH2─CH3 CH2 ═ C ─ CH3
│
n-Buteno CH3
Metilpropeno
Estos compuestos poseen la formula C4H8 , pero su estructura es muy diferente.
La presencia del enlace doble en los alquenos origina dos tipos de isomería , de posición y cis-trans.
ISOMERÍA DE POSICIÓN
Consiste en la posibilidad de que un enlace doble se presente en posiciones distintas en una misma cadena carbonatada:
CH2═CH─CH2─CH3 CH3─CH═CH─CH3
1-Buteno 2-Buteno
Ambos tienen formula general C4H8, pero se diferencian por la ubicación del doble enlace.
Isómeros geométricos
Los isómeros cis-trans tienen la misma cadena con las mismas funciones en las mismas posiciones, pero debido a que la molécula es rígida, cabe la posibilidad de que dos grupos funcionales estén más próximos en el espacio (cis) o más alejados (trans). La rigidez de la molécula se debe normalmente a la presencia de:
- un doble enlace
- un anillo
En el caso del anillo, determinados sustituyentes pueden quedar del mismo lado del anillo (isómero cis) oen lados opuestos (isómero trans).
En el caso de un doble enlace, los sustituyentes más voluminosos pueden quedar del mismo lado del doble enlace y estar más próximos en el espacio (isómero cis) o en distintos lados del doble enlace, más alejados (isómero trans).
Cuando existen varios sustituyentes distintos, la nomenclatura cis-trans puede resultar ambigua. En estos casos se adopta la nomenclatura E-Z. Esta nomenclatura está basada en las palabras alemanas
E = entgegen (separados)
Z = zusammen (juntos)
Para designar cuál es el isómero E y cuál es el isómero Z se siguen reglas muy precisas. En cada carbono, al sustituyente de mayor número atómico se le asigna el número 1 y al otro el número 2. En caso de empate, se sigue el mismo criterio con los átomos unidos a ellos, hasta desempatar.
En consecuencia:
el isómero Z (zusammen) será el que tenga los dos sustituyentes de mayor jerarquía (a los que se ha asignado el número 1) del mismo lado del doble enlace (más próximos en el espacio)
el isómero E (entgegen) será el que los tenga los dos sustituyentes de mayor jerarquía a distinto lado del doble enlace (más separados en el espacio)
ISOMERÍA CIS-TRANS
A diferencia de los enlaces simples, los dobles enlaces dan una rigidez que impiden su rotación , por lo que sus átomos se pueden organizar de dos maneras que corresponden a dos estructuras diferentes .También son conocidos como isómeros geométricos:
Por ejemplo en el 2-Buteno CH3─CH═CH─CH3 :
Para que se de este tipo de isomería es necesario también que los grupos unidos al doble enlace sean diferentes entre si. No como en el 1-buteno que aunque se pueden describir dos estructuras estas son iguales si se cambian de posición.
Gracias por visitarnos...😃





Buena ampliación de información, recuerde emplear vídeos como apoyo en sus explicaciones
ResponderBorrar